Int J Biol Macromol. 2018 Mai:111:1032-1039. doi: 10.1016/j.ijbiomac.2018.01.134. Epub 2018, 31. Januar.
Chemische SS-mPEG-Modifikation der rekombinanten Phospholipase C für verbesserte thermische Stabilität und katalytische Effizienz
Xian Fang 1, Xueting Wang 1, Guiling Li 2, Jun Zeng 2, Jian Li 2, Jingwen Liu 3
Zusammenfassung
PEGylierung ist eine der vielversprechendste und umfassend untersuchte Strategien zur Verbesserung der Eigenschaften von Proteinen sowie der enzymatischen physikalischen und thermischen Stabilität. Phospholipase C, die Phospholipide hydrolysiert, bietet enorme Anwendungsmöglichkeiten in verschiedenen Bereichen. Allerdings schränkten die schlechte thermische Stabilität und die höheren Produktionskosten seine industrielle Anwendung ein. Diese Studie konzentrierte sich auf die Verbesserung der Stabilisierung rekombinanter PLC durch chemische Modifikation mit Methoxypolyethylenglykol-Succinimidylsuccinat (SS-mPEG, MW 5000). Das PLC-Gen aus dem Isolat Bacillus cereus HSL3 wurde mit SUMO, einem neuen kleinen Ubiquitin-verwandten Modifikator-Expressionsvektor, fusioniert und in Escherichia coli überexprimiert. Der lösliche Anteil von SUMO-PLC erreichte 80 % des gesamten rekombinanten Proteins. Das Enzym zeigte die maximale katalytische Aktivität bei 80 °C und war bei 40–70 °C relativ thermostabil. Es zeigte ein umfassendes Substratspezifitätsmuster und eine ausgeprägte Aktivität gegenüber Phosphatidylcholin, was es zu einem typischen unspezifischen PLC für industrielle Zwecke machte. Der SS-mPEG-PLC-Komplex zeigte eine verbesserte thermische Stabilität bei 70–80 °C und die katalytische Effizienz (Kcat/Km) war im Vergleich zu freiem PLC um das 3,03-fache erhöht. Das CD-Spektrum von SS-mPEG-PLC deutete auf eine mögliche Enzymaggregation nach chemischer Modifikation hin, die zur höheren Thermostabilität von SS-mPEG-PLC beitrug. Die Zunahme antiparalleler β-Faltblätter in der Sekundärstruktur machte diese auch stabiler als parallele β-Faltblätter. Das Vorhandensein von SS-mPEG-Ketten auf der Oberfläche des Enzymmoleküls veränderte die Bindungsrate der Substrate etwas, was zu einer deutlichen Verbesserung der katalytischen Effizienz führte. Diese Studie lieferte einen Einblick in die Zugabe von SS-mPEG zur Verbesserung der industriellen Anwendungen von Phospholipase C bei höheren Temperaturen.
Schlüsselwörter: Enzymatische Eigenschaften; Phospholipase C; Rekombinante Expression; SS-mPEG-Modifikation; Thermische Stabilität und katalytische Effizienz.
Verwandte Produkte
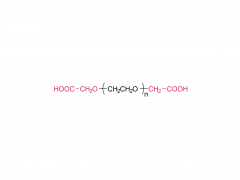
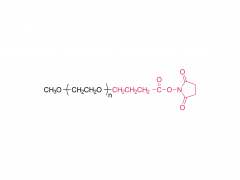
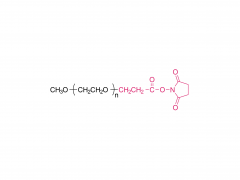
Abkürzung: mPEG-SS
Name: Methoxypoly(ethylenglycol)succinimidylsuccinat
Für weitere Produktinformationen kontaktieren Sie uns bitte unter:
US-Tel.: 1-844-782-5734
US-Tel.: 1-844-QUAL-PEG
CHN Tel.: 400 -918-9898
E-Mail: sales@sinopeg.com