J-Steuerungsfreigabe. 2024 Nov.:375:74-89. doi: 10.1016/j.jconrel.2024.08.049. Epub 2024 5. September.
Optimierung eines anhängigen PEGylierten Linkers für Antikörper-Wirkstoff-Konjugate
Zusammenfassung
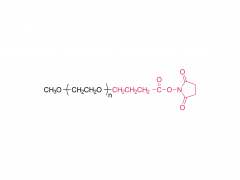
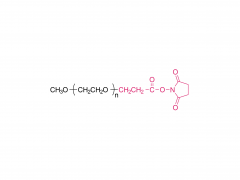
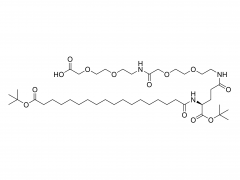
In dieser Arbeit haben wir Antikörper-Wirkstoff-Konjugate (ADCs) konzipiert und entwickelt, die den Wirkstoff nach enzymatischer Spaltung der Linker-Einheit durch Tumorproteasen effizient freisetzen können. Die von uns verwendeten Antikörper-Wirkstoff-Linker sind das Ergebnis einer rationalen Optimierung eines zuvor beschriebenen PEGylierten Linkers, PUREBRIGHT® MA-P12-PS, der hervorragende Wirkstoffbeladungskapazitäten aufwies, aber über keinen eingebauten Wirkstoffabgabemechanismus verfügte, was die Wirksamkeit des Ergebnisses begrenzte ADCs. Um dieser Einschränkung zu begegnen, haben wir uns entschieden, einen Protease-sensitiven Auslöser in den Linker einzubauen, um die Freisetzung eines „PEG-freien“ Arzneimittels in den Tumorzellen zu begünstigen und so wirksame ADCs zu erhalten. Derzeit basieren die meisten vermarkteten ADCs auf dem Val-Cit-Dipeptid, gefolgt von einem selbstzerlegenden Spacer zur Freisetzung des Arzneimittels in seiner unveränderten Form. Hier haben wir zwei unkonventionelle Peptidsequenzen ausgewählt, ein Phe-Gly-Dipeptid und ein Val-Ala-Gly-Tripeptid, und die eine oder andere zwischen dem Medikament auf einer Seite (N-Terminus) und dem Rest des Linkers, einschließlich PEG, platziert Einheit, auf der anderen Seite (C-Terminus), ohne selbstzerstörende Gruppe. Wir fanden heraus, dass beide Linker auf Cathepsin B, ein lysosomales Referenzenzym, reagierten und wie gewünscht einen PEG-freien Wirkstoffkataboliten freisetzten. Anschließend verwendeten wir die beiden Linker, um ADCs auf Basis von Trastuzumab (einem auf HER2 gerichteten Antikörper) und DM1 (einem auf Mikrotubuli gerichteten zytotoxischen Wirkstoff) mit einem durchschnittlichen Arzneimittel-zu-Antikörper-Verhältnis (DAR) von 4 oder 8 zu erzeugen. Die ADCs zeigten eine Wiederherstellung Zytotoxizität in vitro, die proportional zur DM1-Beladung war und im Allgemeinen höher für die ADCs war, die Val-Ala-Gly in ihrer Struktur trugen. In einem Eierstockkrebs-Mausmodell verhielt sich das auf Val-Ala-Gly basierende ADC DAR 8 besser als Kadcyla® (ein zugelassenes ADC von DAR 3,5, das in dieser Studie als Kontrolle verwendet wurde), was zu einer stärkeren Reduzierung des Tumorvolumens und einer längeren mittleren Überlebenszeit führte . Zusammengenommen stellen unsere Ergebnisse einen erfolgreichen Linker-Optimierungsprozess dar und ermutigen die Anwendung des Val-Ala-Gly-Tripeptids als Alternative zu anderen bestehenden Protease-sensitiven Auslösern für ADCs.
Schlüsselwörter: Antikörper-Wirkstoff-Konjugat; Krebstherapie; Spaltbarer Peptidlinker; Arzneimittelabgabe; Optimierung; PEG.
Für weitere Produktinformationen kontaktieren Sie uns bitte unter:
US-Tel: 1-844-782-5734
US-Tel: 1-844-QUAL-PEG
CHN Tel: 400-918-9898
E-Mail: sales@sinopeg.com