Journal of Molecular Catalysis B: Enzymatic
Band 111, Januar 2015, Seiten 36–42
Ortsspezifische Modifikation von gentechnisch verändertem Proteus sp. Lipase K107-Varianten mit einem Polyethylenglykol-Derivat
Höhepunkte
â¢Wir berichten über eine neuartige Methode zur ortsspezifischen PEGylierung von Proteinen.
â¢Lineare mPEGs unterschiedlicher Größe wurden über Dopamin funktionalisiert.
â¢PEG-Derivate wurden zur ortsspezifischen PEGylierung von Enzymen mit einem einzelnen Cys-Rest verwendet.
â¢Die PEGylierten Enzyme behielten ihre Sekundärstrukturen und Aktivitäten bei, die bei PEG-Konjugaten mit niedrigem Molekulargewicht höher waren.
â¢Konjugate mit der Stelle der Polymerkopplung in der Nähe des katalytischen Zentrums waren stabiler.
Zusammenfassung
Die kovalente Bindung von PEG an Zielproteine, bekannt als PEGylierung, hat breite biomedizinische und biotechnologische Anwendungen. Insbesondere die ortsspezifische PEGylierung wird aufgrund ihrer einzigartigen Eigenschaften, die Bioaktivität zu bewahren, die Stabilität konjugierter Proteine zu verbessern und ein hohes Maß an Homogenität zu erreichen, häufig eingesetzt. In dieser Arbeit wurden lineare mPEGs verschiedener Größen (MW = 5, 12 und 20 kDa) über Dopamin funktionalisiert und für die ortsspezifische PEGylierung von Proteus sp. verwendet. Lipase K107-Derivate mit einem einzelnen Cys-Rest, der durch ortsgerichtete Mutagenese auf der lösungsmittelzugänglichen Oberfläche des Proteins eingeführt wurde. Die Spezifität der Konjugation wurde durch SDS-PAGE und MALDI-TOF-Massenspektrometrie verifiziert, und die Sekundärstrukturen der Konjugate wurden durch Zirkulardichroismus verifiziert. PEGylierte Enzyme behielten ihre Aktivität, die bei PEG-Konjugaten mit niedrigem Molekulargewicht höher war. Wichtig ist, dass sowohl der pH-Wert als auch die thermische Stabilität der Enzyme durch die PEGylierung verbessert wurden, insbesondere bei basischem pH-Wert und über Raumtemperatur. Darüber hinaus waren Konjugate mit der Polymerkopplungsstelle in der Nähe des katalytischen Zentrums stabiler. Diese Ergebnisse demonstrieren eine neuartige, effiziente Methode zur ortsspezifischen Proteinmodifikation über Catechol-funktionalisiertes PEG, die möglicherweise auf andere Enzyme angewendet werden könnte.
Ähnliche Produkte
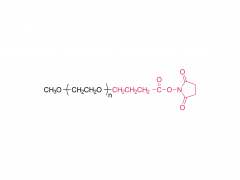
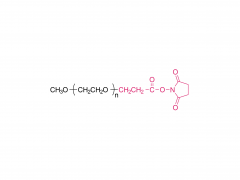
Abkürzung: mPEGs
Für weitere Produktinformationen kontaktieren Sie uns bitte unter:
US-Tel: 1-844-782-5734
US-Tel: 1-844-QUAL-PEG
CHN Tel: 400-918-9898
E-Mail: sales@sinopeg.com