Lipid-Nanopartikel (LNPs) zählen heute zu den erfolgreichsten Nanotransportsystemen und weisen außergewöhnliche Fähigkeiten bei der Verabreichung zytotoxischer Chemotherapeutika, Antibiotika und Nukleinsäuretherapeutika auf. Die Strukturwahl der PEGylierten Lipide, einem Kernbestandteil der LNPs, beeinflusst entscheidend die Sicherheit, Stabilität und Immunogenität der Formulierung.
Hatten Sie schon einmal Probleme mit Immunreaktionen, die durch PEG in LNP-Formulierungen ausgelöst werden? Bereits vorhandene Anti-PEG-Antikörper stellen eine unvermeidbare Herausforderung bei der klinischen Anwendung von mRNA-Arzneimitteln dar. Heute etablieren sich PEG-Lipide mit Hydroxylgruppen (HO-PEG) als „Unsichtbarkeitsmantel“ für die neue Generation von LNPs – sie reduzieren die Immunerkennung deutlich und verbessern die Wirkstofffreisetzung. SINOPEG präsentiert Ihnen… HO-PEG-Lipide mit unabhängigen Schutzrechten für geistiges Eigentum zur Bekämpfung bereits bestehender Anti-PEG-Antikörper.
SINOPEG: Der Marktführer für inländische HO-PEG-Lipide
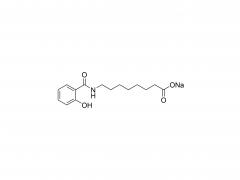
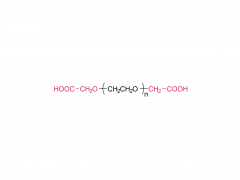
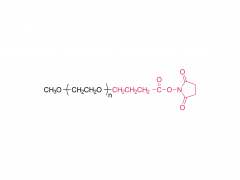
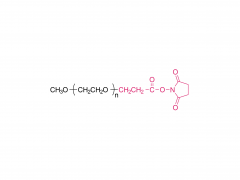
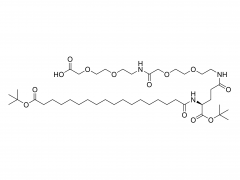
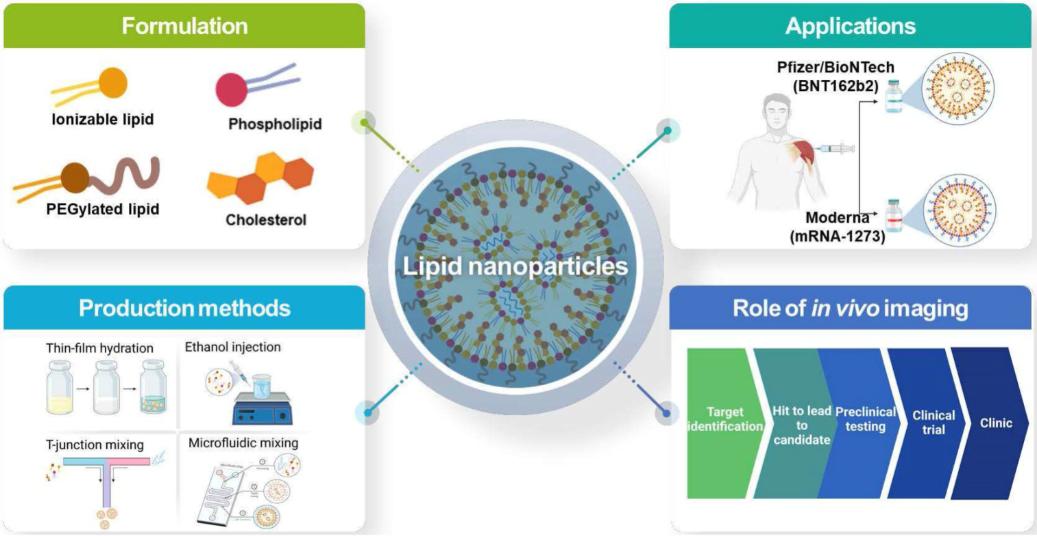
SINOPEG Das Unternehmen engagiert sich seit jeher für die Forschung und Entwicklung neuer Technologien und Produkte. Kürzlich wurden verschiedene neue Lipidstrukturen entwickelt, insbesondere das eigenständig entwickelte DTA-5 (Patentnr.: ZL202280003648.7), ein PEG-Lipid mit einer endständigen Hydroxylgruppe. HO-PEG-DTA-5 verfügt über ein umfassendes globales Portfolio an geistigem Eigentum, das wichtige Märkte wie China, die USA und Europa abdeckt. Die Einreichung der Zulassungsunterlagen (Drug Master File, DMF) in China und den USA steht kurz vor dem Abschluss. Die Struktur des Lipids ist wie folgt:
HO-PEG-Lipide: Warum sind sie die bevorzugte Wahl für LNPs der nächsten Generation?
In den letzten Jahren rückten PEG-Lipide mit Hydroxylgruppen (HO-PEG) aufgrund ihrer signifikanten Vorteile hinsichtlich reduzierter Immunogenität und Vermeidung der Erkennung durch bereits vorhandene Anti-PEG-Antikörper zunehmend in den Fokus der Entwicklung von Lipid-Nanopartikeln der nächsten Generation. Moderna, ein weltweit führendes Unternehmen im Bereich mRNA-Therapeutika, setzt diese Lipide in zahlreichen präklinischen und klinischen Formulierungen umfassend ein und bestätigt damit deren Potenzial.
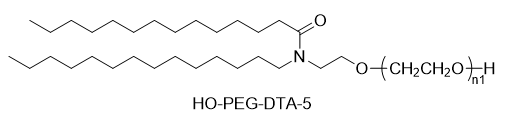
Vor Kurzem veröffentlichte Moderna eine wichtige Studie in Nature Communications mit dem Titel „Charakterisierung des Wirkmechanismus von mRNA-Therapeutika zur Behandlung von Propionazidämie, Methylmalonazidämie und Phenylketonurie“. Diese Arbeit klärt systematisch die Wirkmechanismen dreier mRNA-Therapien zur Behandlung von Stoffwechselerkrankungen (einschließlich Propionazidämie (PA), Methylmalonazidämie (MMA) und Phenylketonurie (PKU)) auf: mRNA-3927 (Prüfpräparat für PA), mRNA-3705 (Prüfpräparat für MMA) und mRNA-3210 (Prüfpräparat für PKU). Alle drei mRNA-Therapien nutzen ein LNP-Verabreichungssystem und zeigten in Mausmodellen günstige pharmakokinetische/pharmakodynamische (PK/PD) Reaktionen, darunter die Expression der Ziel-mRNA, eine erhöhte Proteinaktivität und verringerte Konzentrationen relevanter Metaboliten.
Bei den drei in der Studie verwendeten Therapien wurde eine einheitliche LNP-Formulierung eingesetzt: Das kationische Lipid war SM-86 und das PEG-Lipid war OL-56.
SM-86 wurde bereits in früheren nicht-klinischen Studienberichten zu SPIKEVAX® erwähnt. Es handelt sich um ein Lipid mit struktureller Ähnlichkeit zu SM-102. In Studien mit intravenöser Injektion an Ratten zeigten sich ähnliche pharmakokinetische, Gewebeverteilungs- und Ausscheidungsprofile wie bei SM-102. Es entspricht Lipid 5, das in früheren Forschungen von Moderna zu Lipidträgern beschrieben wurde.
OL-56, basierend auf zuvor veröffentlichten Patentinformationen von Moderna, wird als Polyethylenglykol-Fettsäurederivat (der Formel (VI)) beschrieben, dessen charakteristisches Merkmal eine endständige Hydroxylgruppe (-OH) am PEG ist, d. h. es handelt sich um ein HO-PEG-Lipid. Dieser PEG-Lipidtyp wurde in mehreren Patentdokumenten in Kombination mit verschiedenen ionisierbaren Lipiden (wie Verbindung A, B, II, VI usw.) verwendet und zeigte dabei gute Kompatibilität und hohe Wirkstofffreisetzungseffizienz. Patent WO2022246020A1 offenbart die Formulierung für mRNA-3705 und bestätigt, dass es sich bei der im Patent beschriebenen Verbindung I um das im Artikel erwähnte OL-56 handelt.
Auf Basis pharmakokinetischer (PK) und pharmakodynamischer (PD) Daten aus präklinischen Mausmodellen entwickelte das Forschungsteam präklinische PK/PD-Modelle für jedes mRNA-Therapeutikum. Diese Modelle wurden anschließend erfolgreich zur Vorhersage der Humandosis unter Verwendung allometrischer Skalierung der Modellparameter eingesetzt. Insbesondere für die Studien zu Propionazidämie (PA) und Methylmalonazidämie (MMA) wurden Daten von Mäusen, Ratten und Affen integriert und interspezifische Skalierungsmethoden verwendet, um die Dosis für die erste Anwendung am Menschen (FIH) vorherzusagen. Für Phenylketonurie (PKU) basierten die Vorhersagen primär auf einem krankheitsrelevanten Modell – dem PAHenu2-Mausmodell.
Wie in Tabelle 1 unten dargestellt, betragen die geschätzten FIH-Dosen für die drei mRNA-Therapeutika (mRNA-3927, mRNA-3705 und mRNA-3210) basierend auf den PK/PD-Modellierungsergebnissen 0,3 mg/kg, 0,1 mg/kg bzw. 0,4 mg/kg. Diese Werte liegen signifikant unter den entsprechenden NOAEL-Werten (PA 3 mg/kg, MMA 5 mg/kg und PKU 3 mg/kg) und erreichen Sicherheitsmargen von 10, 50 bzw. 7,5, was auf ein ausgezeichnetes Potenzial für die klinische Sicherheit hinweist.
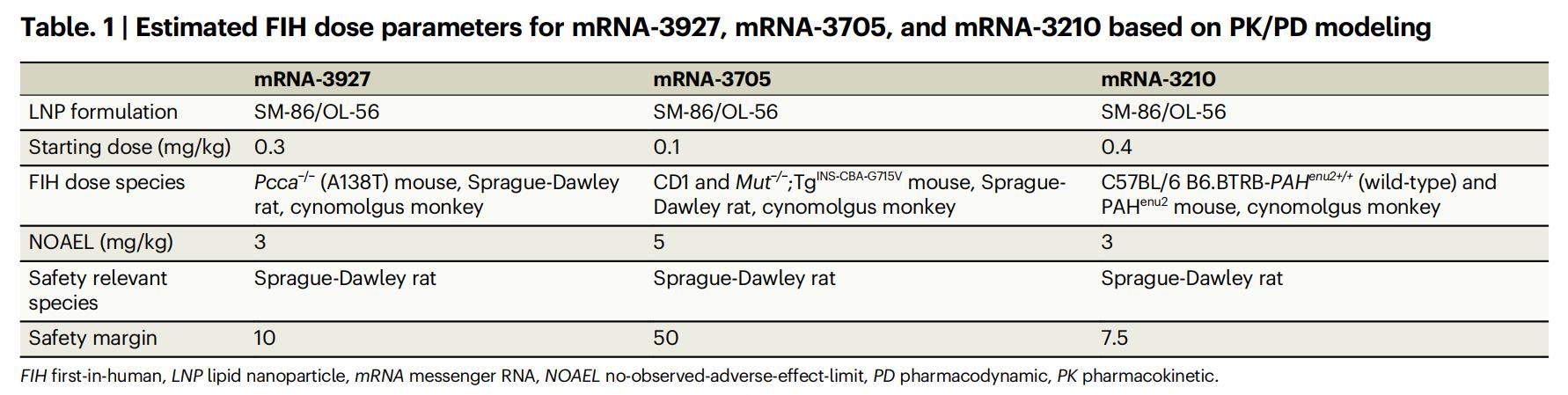
Tabelle 1: Geschätzte FIH-Dosisparameter für mRNA-3927, mRNA-3705 und mRNA-3210 basierend auf PK/PD-Modellierung
Kürzlich veröffentlichte ein Forschungsteam unter der Leitung von Professor Zhan Changyou von der Fakultät für Medizinische Grundlagenwissenschaften der Fudan-Universität eine verwandte Studie zu PEG-Lipiden mit OH-Endgruppen im Preprint-Journal bioRxiv. Diese Studie untersuchte systematisch das Potenzial von PEG-Lipiden mit Hydroxyl-Endgruppen (OH-Terminus) zur Umgehung der Erkennung durch bereits vorhandene Anti-PEG-Antikörper beim Menschen. Durch systematisches Screening von umfangreichen, multizentrischen klinischen Serumproben zeigte die Forschung, dass die Erkennung von PEG-Materialien durch weit verbreitete Anti-Polyethylenglykol-(Anti-PEG)-Antikörper in der Bevölkerung eine signifikante Terminalselektivität aufweist. Hydroxyl-PEG (HO-PEG) zeigte dabei eine außergewöhnliche Fähigkeit zur Immunflucht – es vermied die Bindung an bereits vorhandene Anti-PEG-Antikörper signifikant.
Die Studie nutzte umfassend ELISA, isotherme Titrationskalorimetrie (ITC) und verschiedene funktionelle In-vitro-Assays, um die Bindungseigenschaften von PEG-Materialien mit unterschiedlichen terminalen Strukturen (einschließlich MeO-, HO-, NH₂- und COOH-PEG) an Antikörper systematisch zu vergleichen. Die Ergebnisse in der Abbildung unten zeigen, dass HO-PEG in allen Tests die niedrigsten Immunerkennungsraten aufwies, wobei die positiven Bindungssignale um über 90 % reduziert waren. Besonders bemerkenswert ist, dass speziesübergreifende Vergleiche ergaben, dass präexistierende humane Antikörper primär die terminale PEG-Struktur erkennen, während in Tiermodellen induzierte Antikörper häufig die PEG-Wiederholungseinheiten angreifen. Dieser entscheidende Unterschied deutet darauf hin, dass die Vorteile von HO-PEG in seiner hohen Spezifität liegen und ein erhebliches translationales Potenzial in der klinischen Anwendung besitzen.
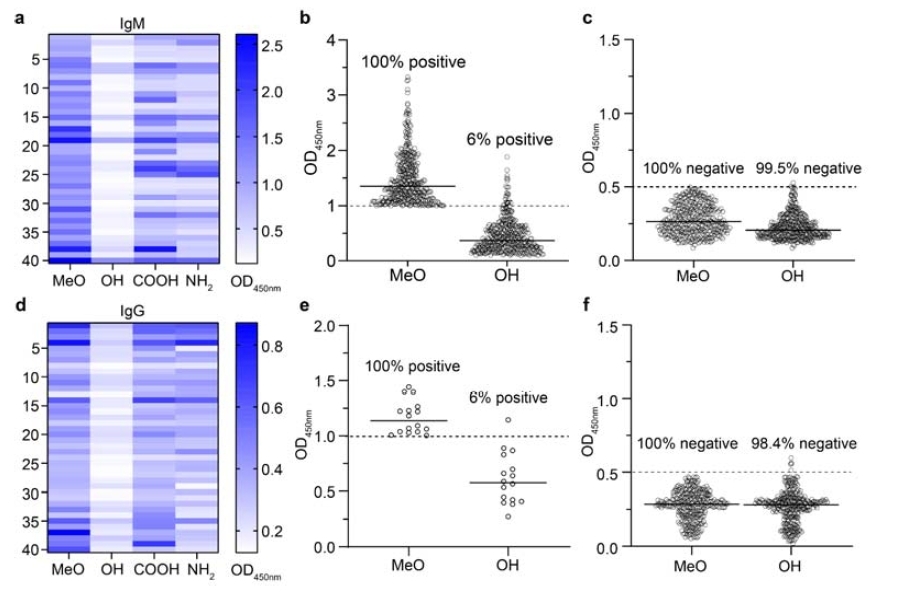
Abbildung: Terminale Selektivität von präexistierenden humanen Anti-PEG-Antikörpern
Zusammenfassend zeigte diese Studie, dass mit HO-PEG modifizierte Lipidnanopartikel (LNPs) im Vergleich zu herkömmlichem Methoxy-PEG (MeO-PEG) die Komplementaktivierung deutlich reduzieren, die Anaphylatoxinbildung verringern, die Plasmastabilität der LNPs signifikant erhöhen und die Aufnahme durch nicht-zielgerichtete Makrophagen in antikörperpositivem Humanserum verringern können. Diese Verbesserungen bieten eine praktikable neue Materialstrategie zur Steigerung der Wirkstofffreisetzung und der In-vivo-Performance von LNP-basierten Arzneimitteln bei gleichzeitiger Reduzierung klinischer immunbedingter Nebenwirkungen.
Sowohl die Studie von Moderna als auch die der Fudan-Universität bestätigen den bedeutenden Wert von PEG-Lipiden mit Hydroxylgruppen als wichtige Hilfsstoffe zur Verbesserung der Formulierungssicherheit und zur Reduzierung von Immunreaktionen. Die Verwendung solcher fortschrittlicher funktionaler Lipidmaterialien wird zu einem entscheidenden Faktor in der Entwicklung von Nukleinsäure-Arzneimittelverabreichungssystemen der nächsten Generation.
SINOPEG bietet nicht nur HO-PEG-Lipide an, sondern auch andere neuartige PEG-Lipidstrukturen: DSPE-PEG-MAL, GaINAC-PEG-C-DSG, OL-56 (HO-PEG-Ste), mPEG-C16-Ceramid, mPEG-DHE-, Biotin-PEG-DMG, DMG-PEG-MAL, HO-PEG-VE, DMG-PEG-Mannose, DSPE-PEG-Galnac, mPEG-DPPE(14:0 PEG2000), mPEG-DMPE(16:0 PEG2000 PE-2K), mPEG-DOPE(18:1 PEG2000 PE-2K).