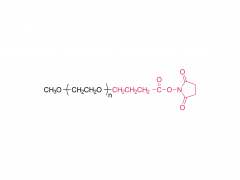
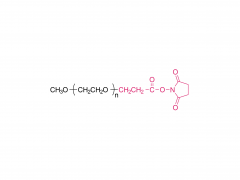
Industriepflanzen und Produkte. Band 152, 15. September 2020, 112497 https://doi.org/10.1016/j.indcrop.2020.112497 Avermectin-beladene Carboxymethylcellulose-Nanopartikel mit stimuliresponsiven und kontrollierten Freisetzungseigenschaften Huaxin Zhu, Yue Shen, Jianxia Cui, Anqi wang, Ningjun Li , Chong Wang, Bo Cui, Changjiao Sun, Xiang Zhao, Chunxin Wang, Fei Gao, Shenshan Zhan, Liang Guo, Liang Zhang, Zhanghua Zeng, Yan Wang, Haixin Cui Abstrakt Polyethylenglykol (PEG) wurde in Carboxymethylcellulose (CMC) eingeführt, um eine hydrophile Kette von PEG-CMC zu bilden. Avermectin (Avm) wurde unter Verwendung von N,N-Dicyclohexylcarbodiimid (DCC) als Dehydrierungsmittel und 4-Dimethylaminopyridin (DMAP) als Katalysator auf die lange Kette von PEG-CMC aufgepfropft, um das amphiphile Molekül zu bilden. Anschließend wurden die Avermectin-Nanopartikel mit einer auf Esterase reagierenden verzögerten Freisetzung erfolgreich durch Selbstorganisation hergestellt. Die Größe der Nanopartikel betrug weniger als 400 nm. Die Avermectin-Beladung betrug 8 % und die Abbaurate lag 72 Stunden lang unter der Xenon-Bogenlampe bei weniger als 50 %. Im Vergleich zu technischem Avermectin zeigte es einen offensichtlichen Vorteil bei der Bekämpfung des Photoabbaus. Im Vergleich zu handelsüblichen wasserdispergierbaren Granulaten (WDG) Die Avermectin-Nanopartikel hatten einen kleineren Kontaktwinkel auf der Gurkenblattoberfläche und es gab einen signifikanten Unterschied. Der Toxizitätstest ergab, dass die Nanopartikel eine gewisse insektizide Wirkung auf die Larve von Hyphantria cunea haben und die Empfindlichkeit mit der Zeit allmählich zunahm. Verwandte Produkte Abkürzung: mPEG-CM Name: Methoxypoly(ethylenglykol)carboxymethyl Für weitere Produktinformationen kontaktieren Sie uns bitte unter: US-Tel.: 1-844-782-5734 US-Tel.: 1-844-QUAL-PEG CHN Tel.: 400-918-9898 E-Mail: sales@sinopeg.com
mehr sehen