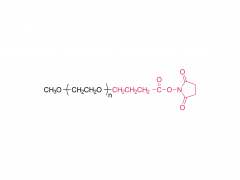
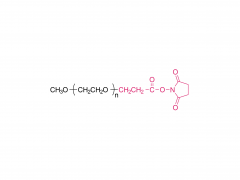
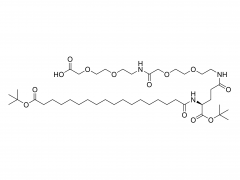
PEG4, PEG8, PEG24 | Einfluss von Polyethylenglykol-, Alkyl- und Oligonukleotid-Spacern auf die Bindung, Sekundärstruktur und Selbstassemblierung von Fraktalkin-bindenden FKN-S2-Aptamer-Amphiphilen
2025-09-09
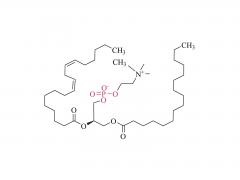
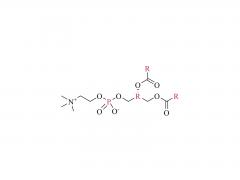
Langmuir. 1. Juli 2014;30(25):7465-74. doi: 10.1021/la500403v. Epub 17. Juni 2014. Einfluss von Polyethylenglykol, Alkyl und Oligonukleotid-Spacern auf die Bindung, Sekundärstruktur und Selbstassemblierung von Fraktalkin-bindenden FKN-S2-Aptamer-Amphiphilen Abstrakt Zuvor haben wir ein Aptamer namens FKN-S2 identifiziert, das das Zelloberflächenprotein Fractalkin mit hoher Affinität und Spezifität bindet. In dieser Arbeit wurde dem Aptamer ein hydrophober Dialkyl-C16-Schwanz hinzugefügt, um ein Aptamer-Amphiphil zu erzeugen. Wir untersuchten, wie der Schwanz und ein zwischen dem Schwanz und der Aptamer-Kopfgruppe eingefügtes Spacer-Molekül unterschiedlicher Länge und Hydrophobie die Bindung, Struktur und Selbstassemblierungseigenschaften des Aptamer-Amphiphils beeinflussen. Wir synthetisierten Aptamer-Amphiphile ohne Spacer (NoSPR), Polyethylenglykol (PEG4, PEG8, PEG24), Alkyl (C12 und C24) oder Oligonukleotid (T10 und T5: 10 und 5 Thymin und A10: 10 Adenin) als Spacer. Das Hinzufügen des Schwanzes reduzierte die Bindungsaffinität des Aptamer-Amphiphils im Vergleich zum freien Aptamer um mehr als das 7,5-fache. Die hydrophoben Alkyl-Spacer führten zum größten Affinitätsverlust, und die hydrophilen PEG-Spacer verbesserten die Amphiphil-Affinität, stellten sie jedoch nicht auf das Niveau des freien Aptamers wieder her. Interessanterweise produzierten Oligonukleotid-Spacer die Amphiphile mit der höchsten Affinität. Die Nukleotidzusammensetzung hatte jedoch keinen Einfluss auf die Affinität, da die T10- und A10-Spacer die gleiche Affinität hatten. Die Amphiphile mit Oligonukleotid-Spacer hatten die höchste Affinität, da der Oligonukleotid-Spacer die Affinität des freien Aptamers erhöhte; das FKN-S2-Aptamer plus Oligonukleotid-Spacer hatte eine höhere Affinität als das freie FKN-S2-Aptamer. Zirkulardichroismus (CD)-Spektroskopie und thermische Schmelzuntersuchungen zeigten, dass das Aptamer eine Stammschleife und einen intramolekularen G-Quadruplex bildet. Der Schwanz stabilisierte die Bildung des G-Quadruplex in einem Puffer stark. Kryo-Transmissionselektronenmikroskopie (Kryo-TEM) zeigte, dass sich die Aptamer-Amphiphile, unabhängig vom verwendeten Spacer, zu Mizellen und Nanobändern zusammenlagerten, flachen, oft verdrehten Doppelschichtstrukturen. Schließlich wurden mit dem FKN-S2-Amphiphil funktionalisierte Liposomen mit Fractalkin-exprimierenden Zellen inkubiert. Das Ausmaß der Bindung war abhängig von der Konzentration des Amphiphils auf der Liposomenoberfläche.
mehr sehen