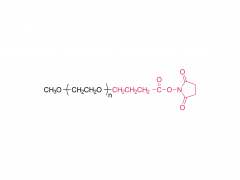
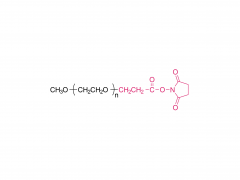
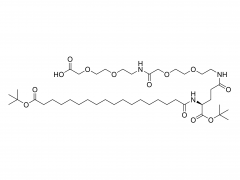
Das Drachenbootfest, auch bekannt als Duanwu-Fest, ist ein traditioneller chinesischer Feiertag mit einer Geschichte von über 2.000 Jahren. Es wird am 5. Tag des 5. Monats des Mondkalenders gefeiert, der im gregorianischen Kalender normalerweise auf Juni fällt. Dieses Fest wird in vielen chinesischen Gemeinden auf der ganzen Welt begangen. Eines der herausragendsten Merkmale des Drachenbootfests sind die spannenden Drachenbootrennen. Ruderteams paddeln energisch zum Schlag der Trommeln und lassen ihre kunstvoll verzierten Boote auf Flüssen und Seen um die Wette laufen. Diese Rennen sind nicht nur ein spannender Sport, sondern auch eine Möglichkeit, den beliebten chinesischen Dichter Qu Yuan zu ehren. Qu Yuan war ein hoch angesehener Dichter und Politiker, der während der Zeit der Streitenden Reiche im alten China lebte. Er war für seine Liebe zu seinem Land und seinen unermüdlichen Kampf gegen Korruption bekannt. Als sein Königreich überfallen und erobert wurde, ertränkte sich Qu Yuan aus Verzweiflung im Fluss Miluo. Um zu verhindern, dass Fische seinen Körper fressen, ließen die Menschen ihre Boote auf dem Fluss um die Wette laufen, spritzten mit Wasser und warfen Zongzi, einen traditionellen Teigtaschen aus klebrigem Reis, als Opfergaben ins Wasser. Zongzi ist ein besonderes Gericht, das mit dem Drachenbootfest in Verbindung gebracht wird. Es wird hergestellt, indem Klebreis mit verschiedenen Füllungen wie Fleisch, Bohnen oder Nüssen in Bambusblätter gewickelt und dann gedämpft oder gekocht wird. Diese köstlichen Leckereien symbolisieren den Reis, der in den Fluss geworfen wurde, um die Fische zu füttern und ihre Aufmerksamkeit von Qu Yuans Körper abzulenken. Neben Drachenbootrennen und Zongzi gibt es beim Drachenbootfest auch andere Bräuche und Traditionen. Die Menschen hängen oft Beutel mit Kräutermedizin, „Zhongzi“ genannt, und Beifußblätter an ihre Türen, um böse Geister und Krankheiten abzuwehren. Außerdem tragen Kinder bunte Seidenfäden, um sich vor bösen Geistern zu schützen und Glück zu bringen. In den letzten Jahren hat das Drachenbootfest auch außerhalb der chinesischen Gemeinden an Popularität gewonnen. Viele Länder haben diesen festlichen Anlass aufgegriffen und Drachenbootrennen organisiert, um das Fest zu feiern.
mehr sehen