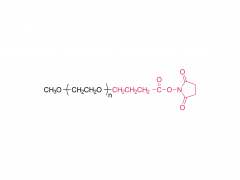
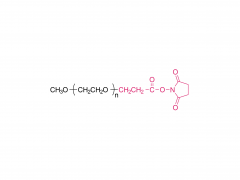
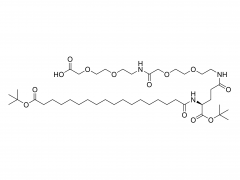
J Exp Med. 2025 Sep 1;222(9):e20241454. doi: 10.1084/jem.20241454. Epub 2025 Jun 6. Membran-IL12-Adjuvans-mRNA-Impfstoff polarisiert Prä-Effektor-T-Zellen für eine optimierte Tumorkontrolle Zusammenfassung Konventionelle mRNA-Krebsimpfstoffe können die Anzahl tumorspezifischer CD8-T-Zellen erhöhen, aber ihre Effektorfunktion könnte beeinträchtigt sein. Spezifische Zytokinsignale können die T-Zell-Differenzierung für eine bessere Tumorabtötung verbessern. Wir haben verschiedene Zytokine gescreent und IL-12 als potentes Adjuvans für mRNA-Impfstoffe identifiziert, allerdings mit signifikanter systemischer Toxizität. Um Wirksamkeit und Toxizität in Einklang zu bringen, haben wir einen membrangebundenen IL-12 (mtIL12)-Adjuvans-mRNA-Impfstoff entwickelt. Dieses Design beschränkt die mtIL12-Expression auf die Oberfläche von antigenpräsentierenden Zellen und aktiviert dadurch selektiv antigenspezifische T-Zellen, ohne benachbarte T- oder NK-Zellen zu beeinflussen. Die mtIL12-Adjuvans-mRNA-Impfung induzierte eine einzigartige Prä-Effektor-T-Zell-Subpopulation, aus der hochreaktive Effektor-T-Zellen hervorgehen, was zu einer überlegenen Antitumoraktivität führt. Darüber hinaus überwand dieser Ansatz die Resistenz gegen Immun-Checkpoint-Therapien und verhinderte die Krebsmetastasierung Unsere Studie hebt hervor, dass mRNA-Impfstoffe der nächsten Generation, die membrangebundene Zytokin-Adjuvantien kodieren, potente Effektor-T-Zellen erzeugen können und so eine effektive Tumorkontrolle bei reduzierter Toxizität ermöglichen. Produkt: Großhandel mit den besten Hilfsstoffen für die DNA/RNA-Übertragung, professionelle Lieferanten von Hilfsstoffen für die DNA/RNA-Übertragung
mehr sehen